|
|
|
|
|
|
デジカメ簡易比色法を利用したプロテアーゼ活性の測定
作業時間:約30分 考察の時間は含めていません。
■ 背景と目的 ■
- 高校の設備でタンパク質などの濃度を求めること(定量)は困難です。定量ができないがために踏み込んだ実験ができないことがよくあります。また、生徒の発展的な考察が期待できないなどの問題点も生じます。
- そこで、特別な機材を使わずにできる定量法を考えました。
- ここでは、デジカメ簡易比色法による定量法を利用した、タンパク質分解酵素の活性実験を紹介します。
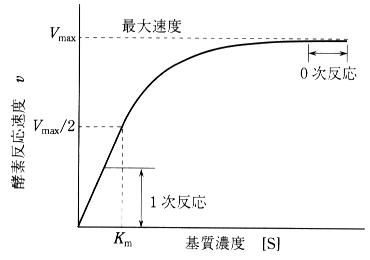
- 以下の図は酵素の性質をグラフ化したもので、教科書によく載っている図です(一部は専門書からの引用なので難しい表記がありますが、高校では反応速度に関する数的処理は行いません)。
現行の酵素実験では定量ができないのでこのようなグラフを導くことはできません。今回、実験によってこのようなグラフを作ります。
■ 用意するもの ■
▼デジカメ簡易比色定量に必要なもの
- デジカメ・・・解像度は気にしなくてよい。携帯電話のカメラでもパソコンに画像を送れれば可能。
- 画像処理ソフト・・・私は使い慣れているAdobeのPhotoshopを利用しましたが、GIMP,Dibasなどのフリーソフトでも可能であることを確認しました。
- パソコン・・・画像処理ソフトを使うため。
- プロジェクタ・・・必須ではありませんが、データの測定の様子を生徒に見せるために使用しました。
 
▼酵素実験に必要なもの
- 酵素・・・コンタクトレンズ用タンパク質分解酵素(旭化成アイミー;マルチワンドロップ)。
ただし、授業の時間内で、かつ定量が可能な濃度であることが必要です。
基礎実験を繰り返した結果、酵素濃度は市販液に等量の蒸留水を加え、50%濃度に調製しました。

- 基質(酵素が反応する相手のこと)・・・市販のスキムミルク。
酵素同様に基礎実験の結果、1.0%に調製。
- 試験管・・・試験管はきれいなもの。傷が付いていたりするとNG。
- 試験管立て,黒い画用紙,目薬のような容器・・・黒い画用紙はデジカメで撮影をするときのバックにする。目薬のような容器とは、酵素の希釈液を入れるもの。
- ストップウォッチ・・・酵素の反応時間を測定します。
- ウォーターバス・・・できればウォーターバスがあれば良いですが、本校にはありませんので、百円ショップで発泡スチロールの箱を買ってきて、お湯を入れながら温度を調節しました。
■ 原理と手順 ■
- スキムミルクにコンタクトレンズ用タンパク質分解酵素を滴下すると、みるみるうちに白濁から透明になっていきます。
このときの透明度からタンパク質濃度を算出します。
撮影時は試験管の後ろに黒い画用紙を置きます。したがって、スキムミルクは白色で、スキムミルクが分解されると黒色に写ります。そのため撮影した画像からは黒色度を測定します。
- 次に、効率よく実験を進めるために以下のような手順で行います。(下図参照)
- 試験管を8本用意します。1本は蒸留水のみ,それ以外の7本にはスキムミルク水溶液を入れておきます。
- それぞれのスキムミルク水溶液に酵素を1分おきに添加します。
ただし、7本のスキムミルク水溶液のうち1本は「反応0分」とするため酵素を入れません。
- 1本目の試験管に酵素を添加してから6分経つ頃に、試験管を一列に並べ、黒い画用紙を後ろに添えて写真を撮ります。
このようにすれば、1グループの実験結果が1枚の写真に集積でき、測定値を出すときに手間も時間もかかりません。
- 下の写真は、実際に生徒が行ったときの写真です。

■ 事前の準備[検量線の作成] ■
- まず、生徒実験前に検量線を作成しておきます。
検量線は測定値から濃度を導くための重要なグラフですので、最も正確に行わなくてはなりません。
また、デジカメで撮影する条件は測定値に影響を与えますので、できるだけ生徒が実験するときと同じ条件で作成します。
例えば、生徒が実験を予定している部屋の、生徒の実験時間帯と同様の時間帯など、また、カーテンを利用したり日照条件をできるだけコントロールします。
撮影条件が測定値に及ぼす影響は、「デジカメ簡易比色法について」のページにて ---> こちら
- 実際に作成した検量線です。グラフ中には測定値と補正値の2本があります。補正の方法や意味は考察にて。
■ 結果 ■
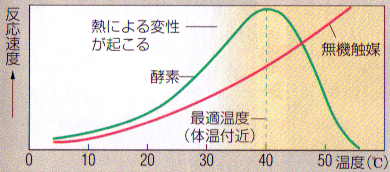
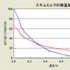
- 温度を変えてそれぞれ反応速度を調査しました。
今回使用した酵素は70℃前後が最適温度であることがわかりました。
一般に、動物細胞の酵素の最適温度は37℃前後、植物細胞は10~20℃などと学習していますが、全くそれとは異なります。
また、学習の中では70℃などという温度は酵素が失活する温度というイメージが定着しつつありますので、生徒にとっては不思議な、またあれこれ考えなくては腑に落ちない実験結果となります。
おそらく好熱性細菌由来なのではないかと思うのですが、販売元に尋ねたところ酵素の由来まではわからないとのことで、詳しいところは定かではありません。
ちなみに、最適温度については概ね実験の結果通りとのコメントを頂きました。

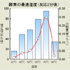
- 上の結果をもとに、反応2分後での温度別の反応速度をグラフにしてみました。
酵素の性質を学習する上で必ず教科書に登場するあのグラフです。
概ね期待通りのグラフになっています。
- 酵素濃度と反応速度の関係を調査しました。
実験は、後々生徒が行うことを目標にしていますので、酵素の添加は、目薬のような容器から滴下する一滴量としました。
(研究施設ならばマイクロピペットを使えますが、高校にはないので。)
すると、希釈の割合によって粘度が異なり、同じ一滴でも重さが異なります。
そこでその数値を補正すると、図に示すような理想の比率がでます。
実験では酵素濃度が近い場合には理想に近い分解速度を示していましたが、酵素濃度が離れた試料同士では理想の分解比率とは言い難いです。
ただ、酵素濃度が高くなるにしたがって分解速度も上昇することは確かなので、実験が失敗というわけではなく、改良の余地があることを示唆しているのではないかと思います。

- 念のためスキムミルクが分解されていることを証明するために、「SDS-PAGE」という電気泳動によって調査しました。
左から1番目はマーカー,2番目は酵素のみ,3番目はスキムミルク+酵素,4番目はスキムミルクのみです。
3番目の酵素は濃縮操作をしていませんので量が少ないことと、写真の写りや画質が悪いので見づらいですが、酵素のバンドだけが確認できています。スキムミルクが分解されて、酵素だけが現れたということです。

■ 生徒の様子 ■
- 課外授業で行いました。
生徒一人一人がそれぞれの条件を担当して、各個人ごとに実験を行いました。
まず、酵素や基質,試験管,ストップウォッチなど必要のものを用意します。

- 酵素反応がスタートすると、1分という短い時間に追われて実験を行います。
生徒は、時間に追われ、また不慣れな作業を行いますので、入念にシュミレーションをします。

- 実際に撮影した画像です。50℃の条件で行いました。
左から順に分解が進んでいることがわかります。

- ゆくゆくは生徒に画像処理ソフトを使ってもらって、測定値を出していきたいと思いますが、まだ、情報教育(パソコンの操作方法)もそのレベルまで達していないので、今回は私がソフトを操作し、測定値を読み上げました。
このとき、プロジェクタを利用して私のパソコン操作が見えるようにし、生徒が「自分の実験の測定値」という認識を得られるように工夫しました。

- 得られた測定値から数的処理を行い、濃度を求め、自分の担当する実験条件の結果を、集計グラフに記入します。

- 自分の結果のみならず、集計グラフなども参考にしながら結果を考察していきます。

- この実験のねらいの一つは、発展的な考察力を育むことです。
はっきりとした数的データがあり、また、酵素は多くの他の実験よりも(反応速度など)理論通りの挙動を示します。ちょっとした数学力が必要になりますが、この考察だけでも1時間費やす価値があります。
また、教科書などで学習する消化酵素とは異なる点もあり、想像力や考察力を発揮するためには面白い素材だと感じました。

■ 考察 ■
- 限られた技術,機器,時間,扱いやすさ,生徒の馴染みやすさ,安全性,材料の調達方法や価格などを考慮すると、今回の実験で用いたスキムミルクとレンズ用タンパク質分解酵素は格好の素材です。
それにより、二次曲線の検量線を使わざるを得ないのですが、この際多少の精度の曖昧さは目をつむらなくてならないでしょう。
特にビューレット反応などのように劇物は扱いませんし、実験で生じた廃液を捨てる際にもすべて流しに捨てられるものばかりなので生徒にとっても教師側にとっても好都合です。
- ニンヒドリン反応,ビウレット反応などを利用できないか検討したが、不適応でした。
また、酵素反応の速度に及ぼす温度や酵素濃度の影響だけでなく、pHの影響も実験したかったのですが、スキムミルクに含まれるカゼインの性質上不可能でした。
- 下の写真はビウレット反応の様子です。左から「1.0%」「0.6%」「0.2%」、さらに「蒸留水」「酵素(添加量1滴)添加」です。当然ながら酵素にも反応してしまうし、また、酵素を構成するタンパク質とカゼインタンパク質に対する呈色の色が異なるため、ビウレット反応では比色定量が無理です。

- 下の写真はニンヒドリン反応の様子です。左から酵素反応「0分」,「1分」・・・「4分」,「蒸留水」です。当然ながらスキムミルクにはアミノ酸が入っていますのでどれも反応しますが、分解とともにアミノ酸量が増えるとはなりませんでした。ペプチドくらいまでしか分解できないのでしょう。

- 今回の実験は、デジカメや画像処理ソフトなどの一般的な道具や、市販されているスキムミルクやレンズ用の酵素を使っていることが特にアピールしたい点です。
画像処理ソフトについては慣れない人にとっては取っつきにくいでしょうが、画像は編集しないしカーソルを測定したいポイントにあわせるだけです(クリックもしません)。
器具を改造したりすることもなく、誰にでも実験ができます。
- 精度については、分光光度計には及びませんが、Lowry法で示したとおり決していい加減なものではありません。特にクラブ活動や課外活動で力を発揮する測定法だと思いますし、私も次のプランを計画中です。まだ補足事項もいくつかありますが、発表など別の機会にて詳細を紹介したいと思います。
|
|
|























